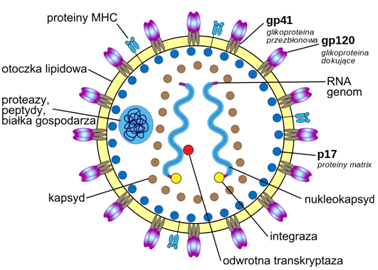
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
据WHO统计,2015年全世界约有3670万人HIV携带者,其中大部分都在低中等收入国家。据估计2015年新感染HIV的人数约为210万人。迄今为止已经有3500万人死于HIV感染,其中2015年有110万人。自1987年WHO宣布HIV大流行以来,HIV感染已经导致了3900万人死亡,目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的7月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nature:重大突破!利用奶牛快速产生HIV广谱中和抗体
图片来自Juan Perilla。
科学家们长期以来就在寻求一种会引起HIV广谱中和抗体(broadly neutralizing antibodies, bNAb)产生的HIV疫苗,这被认为是阻止众多HIV病毒毒株感染的关键。但是这被证实是一项困难的任务;仅大约20%的HIV感染者产生这些抗体。根据一项新的研究,奶牛可能胜任这项任务。相关研究结果于2017年7月20日在线发表在Nature期刊上,论文标题为“Rapid elicitation of broadly neutralizing antibodies to HIV by immunization in cows”。
在过去几年里,一些人已发现HIV广谱中和抗体往往是比较大的难以控制的蛋白。除了这一发现之外,其他的科学家们碰巧发现奶牛的抗体往往是类似地较大的和难以控制的。论文第一作者、国际艾滋病疫苗计划(International AIDS Vaccine Initiative)抗体发现与开发主任Devin Sok说,“这是通力合作的结果。我们当中有兽医、奶牛抗体科学家和HIV科学家,大家一起讨论和想法解决这个相对简单的问题。”
足够确信的是,利用一种在抗原性上模拟HIV包膜糖蛋白(Env)的蛋白免疫原(即BG505 SOSIP)对四只奶牛进行免疫,Sok和他的同事们能够在奶牛中引发他们一直在寻找的HIV广谱中和抗体产生。在免疫头两个月后,他们从这些奶牛体内抽取血液样品,分离出这些血液样品中的抗体,并且在体外证实这些抗体有效地阻断多种HIV毒株感染细胞。
2.PLoS Pathog:HIV感染者为何普遍遭受神经认知障碍?
在一项新的研究中,加拿大阿尔伯塔大学认为他们如今更加清晰地了解HIV感染者为何如此普遍地遭受痴呆和其他的神经认知障碍。
这些研究人员比较了10名没有神经症状的HIV感染者的大脑组织和20名遭受HIV相关神经认知障碍(HIV-associated neurocognitive disorder, HAND)的大脑组织,结果发现HAND患者具有较高水平的影响过氧化物酶体产生所需的蛋白表达的微RNA(microRNAs, miRNA)。过氧物酶体是一种亚细胞结构。据预测,一小部分上调表达的miRNA(miR-500a-5p, miR-34c-3p, miR-93-3p and miR-381-3p)靶向过氧化物酶体生物发生因子PEX2、PEX7、PEX11B和PEX13。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“MicroRNAs upregulated during HIV infection target peroxisome biogenesis factors: Implications for virus biology, disease mechanisms and neuropathology”。
论文通信作者、阿尔伯塔大学医学与牙科学院细胞生物学教授、加拿大RNA病毒与宿主相互作用首席研究员Tom Hobman说,“许多至关重要的过氧化物酶体蛋白对大脑发育和功能是非常重要的,但在HIV感染者大脑中几乎不存在。”
3.PLoS Pathog:利用心脏毒素揭示HIV-1自我整合到T细胞基因组机制
在一项新的研究中,英国伦敦大学学院的Alexander Zhyvoloup和同事们通过比较正常的HIV-1“野生型”毒株和它的突变型毒株,试图更多地认识HIV-1的生命周期。他们让这两种毒株感染CD4+ T细胞,随后测试让这些细胞接触一长串化合物的影响。
这种化学物筛选表明相比于发生突变的HIV-1毒株,一种被称作地高辛的化合物更强地抑制野生型HIV-1毒株。地高辛是一种源自植物的心脏毒素,经常被用来治疗多种心脏病。随后的RNA测序提示着地高辛抑制HIV-1基因表达,而且也抑制CD4+ T细胞的激活和代谢。
进一步的分析表明相比于发生突变的HIV-1毒株,野生型HIV-1往往更加频繁地自我整合到影响CD4+ T细胞激活和代谢的基因中或附近。地高辛也抑制这些相同的T细胞基因,而且鉴于整合性HIV-1的复制需要转录附近的基因,这就对野生型HIV-1为何对地高辛更加敏感提供一种解释:地高辛抑制这种病毒更加频繁地靶向整合的基因。
这些研究人员报道,他们的发现代表着首次证实T细胞激活上的变化和HIV-1靶向特异性的整合位点之间存在功能上的关联。这些结果可能对HIV-1潜伏产生影响。在潜伏状态下,整合性HIV-1潜伏在人基因组中直到在随后的一个时间点上再次激活。
4.Nat Commun:利用分子动力学模拟揭示HIV衣壳与它的环境之间的相互作用
图片来自Juan Perilla。
在一台超级计算机上花了两年时间模拟HIV衣壳生命的1.2微秒。HIV衣壳由6400万个原子组成,是一种将HIV病毒运送到人细胞的细胞核中的蛋白笼状物。这种模拟为这种病毒如何检测它的环境和完成它的感染周期提供新的认识。相关研究结果于2017年7月19日在线发表在Nature Communications期刊上,论文标题为“Physical properties of the HIV-1 capsid from all-atom molecular dynamics simulations”。
论文通信作者、美国伊利诺伊大学研究科学家Juan R. Perilla说,“我们正在了解HIV衣壳系统的细节,不仅是它的结构,而且是它如何改变它的环境,并对它的环境作出反应。”这些细节可能有助科学家们发现打败这种病毒的新方法。
这种衣壳模拟是在美国能源部的泰坦(Titan)超级计算机上开展的。分析这些数据需要伊利诺伊大学国家超级计算应用中心的蓝水(Blue Waters)超级计算机。
Perilla说,这项新的研究揭示出这种衣壳的几种性质可能增强它检测它的环境和发现它通往细胞核的路径的能力。比如,它证实这种衣壳的不同部分按照不同的频率振动。他说,这些振动可能将信息从这种衣壳的一部分传递到它的另一部分。
这项研究也揭示出离子流进和流出这种衣壳上的孔。阴离子聚集在这种衣壳内部的带正电荷的表面上,而阳离子附着到这种衣壳的带负电荷的外表面上。
这种正电荷内部也可能有助促进DNA构成单元(即核苷酸)流入。Perilla 说,HIV需要来自宿主的这些分子,将它自己的RNA转化为DNA。他说,这些DNA构成单元携带着负电荷,而且足够小以至于能够通过这种衣壳上的孔。
5.ACS子刊:蚕丝蛋白可让基于蛋白的HIV抑制剂在高温下长期保持有效
局部使用基于蛋白的HIV抑制剂,也就是利用一种携带这些HIV抑制剂的可插入性薄膜阻止HIV性传播,似乎是一种最好的选择,然而除非得到谨慎处理,基于蛋白的药物容易降解。冰箱是解决这个问题的关键。较高的温度会使得这些药物丧失效力。
为了解决这个问题,来自加州大学默塞德分校的Patricia LiWang团队与来自美国塔夫茨大学的David Kaplan团队合作,开发出一种基于蚕丝的系统,即蚕丝蛋白圆盘状结构(silk fibroin disk),这种系统能够储存、稳定化和局部施用基于蛋白的HIV抑制剂。Kaplan团队之前已发现,作为在蚕丝中发现的一种蛋白,蚕丝蛋白能够让蛋白稳定化而无需使用冰箱。相关研究结果近期发表在美国化学协会旗下的ACS Biomaterials Science & Engineering期刊上,论文标题为“Stabilization and Sustained Release of HIV Inhibitors by Encapsulation in Silk Fibroin Disks”。
LiWang和她的合作者们证实他们的蚕丝稳定化的HIV抑制剂在高达50℃下可在一年内保持有效。尽管其他的药物在这种高温下比较脆弱,但是这些HIV抑制剂在几乎任何环境下保持效力。在撒哈拉以南非洲地区等地方,那些最容易感染上HIV的人仅有有限的资源来冷藏这些抑制剂。
6.Retrovirology:整合到人基因组中的古老逆转录病毒有助抵抗HIV-1感染

图片来自Kazuaki Monde博士。
在我们的进化过程中,病毒持续地感染人体。一些早期的病毒已整合到我们的基因组中,如今它们被称作为人内源性逆转录病毒(human endogenous retroviruses, HERV)。在上百万年来,它们因它们的遗传密码发生突变或较大的缺失而变得没有活性。如今,作为研究得最多的HERV家族之一是HERV-K家族,该家族自从人类和黑猩猩在进化上分开以来就变得活跃,而且它的一些成员在过去几十万年里可能活跃地感染人类。
HERV成为HIV研究人员的关注目标是因为已有研究证实在那些HIV感染者中,T细胞产生抵抗HERV的免疫反应。如今,据认为HERV表达是由HIV感染导致的,而且通过靶向HERV抗原而不是不断发生突变的HIV抗原,HIV将变成一种更容易的靶标。在提出这种看法之后,日本熊本大学之前开展的一项研究已揭示出HIV-1组特异性抗原(group specific antigen, Gag)和HERV-K Gag共组装与HIV-1颗粒增殖能力和感染性下降存在明显的关联性。在当前的一项新的研究中,来自熊本大学的这些研究人员寻求阐明HERV-K Gag如何以这种方式影响HIV-1。
他们报道在早期的共组装阶段,HERV-K Gag改变后代HIV-1颗粒的大小和形态。这发生的原因在于HERV-K Gag衣壳(即HERV-K病毒蛋白衣壳)部分上与HIV-1 Gag在细胞膜上共定位(或者说重叠)。这也会导致成熟的HIV-1颗粒数量下降、HIV-1更慢地释放和感染性下降。相关研究结果近期发表在Retrovirology期刊上,论文标题为“Molecular mechanisms by which HERV-K Gag interferes with HIV-1 Gag assembly and particle infectivity”。
7.JCI:对伏立诺他进行间隔给药可逆转HIV潜伏性
努力开发治愈全球将近4000万HIV感染者的疗法的过程中,让潜伏的HIV病毒库暴露出来以便它们能够被清除掉是一种正在接受测试的策略。在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员证实对药物伏立诺他(Vorinostat)进行间隔给药(interval dosing)可逆转HIV潜伏,并且在HIV感染者中是耐受良好的。然而,尽管伏立诺他让潜伏的HIV更容易被检测到,但是它并不清除感染,这意味着还需取得进一步的进展才能达到治愈。相关研究结果于2017年7月17日在线发表在Journal of Clinical Investigation期刊上,论文标题为“Interval dosing with the HDAC inhibitor vorinostat effectively reverses HIV latency”。
这些研究人员在利用标准的抗病毒疗法对HIV病毒载量加以控制的16名感染者中研究了伏立诺他。伏立诺他按照48小时或72小时间隔进行给药。他们发现当每三天一次进行伏立诺他给药时,HIV能够更加容易地在潜伏感染的CD4+ T细胞中被检测到,即便血液中的病毒载量控制得到维持,也是如此。
8.Nature:首次捕捉到HIV包膜蛋白过渡状态的结构图
在全世界,人免疫缺陷病毒(HV)当前感染着大约3700万人。HIV具有一种关键的被称作包膜蛋白(Env)三聚体的蛋白复合物。开发一种能够阻断而不仅是控制HIV感染的疫苗在很大程度上受到Env的复杂结构的阻碍。
在一项新的研究中,来自美国斯克里普斯研究所(TSRI)、沙克生物研究所和康奈尔大学威尔医学院的研究人员首次解析出Env蛋白复合物的原子水平的特写结构图。这种结构图揭示出Env三聚体的不同部分之间发生的复杂构象变化。这些构象变化仅在这种病毒在正常情形下与一个免疫细胞的质膜融合之前发生。这些发现可能为设计HIV疫苗提供潜在的新靶标。相关研究于2017年7月12日在线发表在Nature期刊上,论文标题为“Open and closed structures reveal allostery and pliability in the HIV-1 envelope spike”。
若要HIV感染发生,Env首先必须结合T细胞外表面上的两个蛋白:先是结合被称作CD4的膜受体,随后结合一个被称作CXCR4或CCR5的辅助受体。在这项新的研究中,这些研究人员构建出一种蛋白,该蛋白包括一种结合到CD4和17b上的修饰性Env(经过基因改造提高其稳定性)。作为一种人抗体,17b类似于CXCR4/CCR5,被用作这些辅助受体的替代物。这种三聚体复合物随后被嵌入到薄薄的一层冰中,并且被放置在冷冻电镜中进行成像。
论文共同第一作者、TSRI高级研究员Jesper Pallesen说,“电子束被这些蛋白原子散射,从而获得详细的二维图片。我们拍摄了大约2000张图片,每张图片含有上千个在随机定向下冻存的Env复合物。我们通过计算让它们对齐,从而构建出高分辨率的三维结构图。”
这些研究人员也开展了第二个抗体替代物实验,从而获得迄今为止最为清晰的能够改变形状的Env的结构图。Ward说,“鉴于Env是一种亚稳态的融合机器,人们长期以来就已了解到它必须是一种具有可塑性的结构。”
利用一种具有类似形状的抗体b12替换CD4,这些研究人员能够证实除了一种“封闭”状态(CD4结合位点受到隐藏)和一种开放状态(准备CD4结合)之外,Env也扭曲成一种部分开放的容纳得下b12但容纳不下CD4的构象。
9.Cell Host Microbe:HIV劫持细胞表面上的分子侵入细胞
在一项新的研究中,来自美国国家卫生研究院(NIH)和埃默里大学的研究人员发现HIV将它的遗传物质注射到细胞中的这个过程的一个关键步骤。通过研究细胞培养物和组织,他们利用化学手段阻断这个步骤就可阻止这个入侵步骤,从而阻止HIV遗传物质进入细胞中。这项研究是由NIH旗下的国家儿童健康和人类发展研究所(NICHD)研究员Leonid V. Chernomordik博士领导的。相关研究结果发表在2017年7月12日的Cell Host & Microbe期刊上,论文标题为“Fusion Stage of HIV-1 Entry Depends on Virus-Induced Cell Surface Exposure of Phosphatidylserine”。
为了感染宿主细胞,HIV表面上的包膜糖蛋白(Env)结合到细胞表面上的CD4受体和辅助受体。这种结合过程启动一连串事件发生,最终导致HIV外膜与细胞膜融合。这种病毒的遗传物质随后进入细胞中。这些研究人员发现这种结合过程激活一种被称作TMEM16F的蛋白,这种蛋白将细胞膜内的一种被称作磷脂酰丝氨酸(phosphatidylserine)的分子转移到细胞膜的外表面上。他们认为病毒外膜上的分子与细胞表面上暴露的磷脂酰丝氨酸结合,从而促进这种病毒与细胞膜融合。
10.JEM:自身免疫疾病的障碍或将开启HIV新型疗法的大门
日前,一项刊登在国际杂志Journal of Experimental Medicine上的研究报告中,来自科罗拉多大学医学院的研究人员通过研究发现了能够保护机体抵御自身免疫疾病的过程,然而该过程能够抑制机体免疫系统产生中和HIV-1的抗体,相关研究或能帮助研究人员开发出一种新型疫苗来刺激机体产生HIV的中和性抗体。
有些感染HIV-1的患者的机体中往往会产生广谱中和性抗体(broadly neutralizing antibodies, bnAbs),这些抗体能够通过识别HIV病毒表面名为Env的蛋白来抑制多种HIV-1对机体的感染,但仅仅当患者感染多年后机体中才会产生这类抗体,因此研究人员想通过研究阐明如何快速诱导bnAbs产生来抵御HIV-1的感染。
研究者首先在能够引发狼疮样症状的遗传缺陷小鼠中进行检测,结果发现,当注射明矾后,小鼠机体中就能够产生有效中和HIV-1的抗体,明矾是一种能够促进抗体分泌的化学物质,其通常用作免疫佐剂。随后研究者利用能够损伤免疫耐受性的药物来处理正常健康的小鼠,结果发现,这些小鼠开始产生能够中和HIV-1的抗体,而且注射明矾还能够促进这些抗体的产生,如果将HIV-1蛋白Env注射到小鼠机体中,其就能够产生中和多种HIV-1毒株的潜在bnAbs。
在所有情况下,HIV-1中和性抗体的产生都和机体中能够识别组蛋白H2A的自我反应性抗体的水平直接相关,随后研究者对这些抗H2A抗体进行了纯化,结果证实其能够中和HIV-1。研究者Torres指出,这或许是能够反映分子模拟的一个例子,即HIV-1的Env蛋白能够不断进化模拟组蛋白H2A的表位使其作为一种免疫伪装的机制;免疫耐受能够消除或抑制任何产生识别组蛋白H2A抗体的B细胞,从而限制bnAbs的产生。
最后研究者表示,通过突破外周免疫耐受机制就能够促进中和HIV-1的可交叉反应抗体的产生,目前本文研究仅在动物模型中进行,研究者想通过更深入的研究来确定人类机体中HIV免疫力的相关性,因此研究者希望可以深入研究确定,是否免疫耐受机制能够在不引发有害自身免疫疾病表现的前提下出现短暂放松,同时以这种机制作为潜在的方法来促进抵御HIV-1的bnAbs的产生。
11.NEJM:研究表明微生物防治对HIV治疗有益!
根据新英格兰医学杂志7月20日发表的一项研究,对于正在开展抗逆转录病毒疗法(ART)的艾滋病毒感染者进行抗病毒治疗(ART),增强预防与在24周和48周的死亡率下降有关。
津巴布韦大学哈拉雷临床研究中心的James Hakim博士及其同事报道了由连续的甲氧苄啶 - 磺胺甲恶唑加上至少12周的异烟肼 - 吡哆素,12周氟康唑,5天阿奇霉素,单剂量的阿苯达唑与单剂量甲氧苄氨嘧啶—磺胺甲恶唑组成的增强微生物预防治疗组合对开始抗病毒治疗的艾滋病毒患者的治疗效果。共有1 805名患者被随机分配到预防性增强(906例)或标准预防(899例)组,随访48周。
研究人员发现,24周时Kaplan-Meier分析中与死亡标准预测相比,死亡率较低(8.9与12.2%;风险比为0.73);总体而言,48周时分别有11.0%和14.4%的患者死亡(风险比为0.76)。增强型预防组患者的结核病,隐球菌感染,口腔或食管念珠菌病,未知原因死亡和新住院率明显降低。